Si te decimos “sólido, líquido y gaseoso” seguro que piensas en el agua ¿verdad? Y está bien que lo hagas, porque el agua es la única sustancia que existe de forma natural en los tres estados de la materia. Pero tal vez te sorprenda saber que no son los únicos que existen: los avances de la tecnología han permitido descubrir que existen otros estados, y aprenderemos sobre ellos también.
En este post te vamos a explicar todo sobre los estados de agregación de la materia, que es el nombre más correcto con el que deberíamos llamarlos. Pero vamos a comenzar desde el principio para que te resulte bien fácil: veremos qué es la materia, cuáles son las características de cada uno de los estados, y cómo es que la materia puede pasar de un estado a otro.
ÍNDICE DE CONTENIDOS
Estados de la materia
Los estados de agregación de la materia, o más simplemente los estados de la materia, son las distintas fases o estados de agregación en los que puede encontrarse la materia, dependiendo del tipo y de la intensidad de las fuerzas de unión que existan entre sus partículas (átomos, moléculas, iones.)
Si te ha resultado un poco difícil de entender, vamos a dar un paso atrás y comenzar desde el principio:
¿Qué es la materia?
Según el diccionario de la RAE, la materia es la “realidad espacial y perceptible por los sentidos de la que están hechas las cosas que nos rodean y que, con la energía, constituye el mundo físico”. Todas las cosas y los seres vivos estamos compuestos por átomos, moléculas y iones que forman la materia. Todo lo que nos rodea, incluso nosotros, ocupamos un espacio (volumen) y tenemos una masa (la cantidad de materia de la que estamos compuestos).
Las partículas que forman la materia se agrupan de maneras diferentes; estas diferencias dan lugar a que la materia se pueda encontrar en distintos estados. Los que se producen de forma natural son cuatro: sólido, líquido, gaseoso y plasmático. Hay otros estados que pueden encontrarse en situaciones creadas en un laboratorio, como el condensado de Bose-Einstein, pero vamos a explicaros muy bien cada uno.
Sólidos

En el estado sólido las partículas están comprimidas, por lo que se mueven poco. Esto significa que los objetos en estado sólido presentan una forma y un volumen definidos. Al estar las moléculas ya comprimidas, no puede reducirse su volúmen porque no pueden comprimirse más. Esto significa que cuando se fragmenta un sólido, se obtienen otros sólidos más pequeños.
Las características de los objetos en estado sólido son:
- Tienen forma y volumen constantes, aunque existen sólidos maleables, como por ejemplo la arcilla, que pueden cambiar de forma.
- No es posible reducir su volumen sometiéndolos a presión.
- Se dilatan (aumentan su volumen con el calor) y se contraen (disminuyen su volumen cuando se enfrían)
Existen dos tipos de sólidos:
- Sólidos cristalinos: . Sus partículas se ordenan en celdillas de forma geométrica, así que suelen tener una forma regular.
- Sólidos amorfos o vítreos: Las partículas que los componen no tienen una estructura ordenada.
Algunos ejemplos de sólidos: la madera, las piedras, los huesos.
Líquidos

En el estado líquido las partículas que forman la materia están unidas entre sí, pero la fuerza de atracción que las une es mucho más débil y menos ordenada que en los sólidos. Por este motivo las partículas se mueven, chocan entre sí, vibran y se deslizan unas sobre otras. La consecuencia es que los líquidos no tienen una forma definida, sino que adquieren la forma del envase que los contiene.
Propiedades:
- No tienen forma, pero sí volumen.
- Adoptan la forma del recipiente que los contiene.
- Fluyen fácilmente si no están contenidos en un recipiente. Por eso, junto con los gases, reciben el nombre de fluidos.
- Se dilatan y contraen al calentarse y enfriarse, al igual que los sólidos.
Algunos ejemplos de líquidos: el agua, el mercurio, la sangre.
Gases

En los gases las partículas se encuentran dispersas y alejadas entre sí, tanto que apenas pueden mantenerse unidas. La fuerza de atracción entre ellas es muy débil, por lo que se encuentran desordenadas, responden poco a la fuerza de gravedad y por ello ocupan un volumen mayor que líquidos y sólidos, porque las partículas tienden a expandirse hasta ocupar la totalidad del espacio en el que están contenidas.
Propiedades:
- No tienen forma ni volumen constantes.
- Experimentan una gran variación de volumen cuando cambian las condiciones de temperatura y presión.
- Adquieren la forma y el volumen del espacio en el que están contenidos.
- Se pueden comprimir fácilmente.
- Tienden a mezclarse con otras sustancias gaseosas, líquidas e incluso sólidas.
- Se dilatan y contraen como los sólidos y los líquidos.
Algunos ejemplos de sustancias gaseosas: aire, nitrógeno, helio.
Plasma

El plasma está compuesto por átomos que han perdido su carga de electrones al ser sometidos a temperaturas y presiones extremadamente altas. En estas condiciones los impactos entre electrones son muy violentos, por lo que se separan del núcleo. El resultado es un gas ionizado, es decir una especie de gas compuesto por aniones y cationes (iones con carga negativa y positiva, respectivamente), separados entre sí y libres, por eso es un excelente conductor eléctrico y magnético.
Existen dos tipos de plasma:
- Plasma frío: se manejan a temperatura ambiente porque solo los electrones están cargados de energía.
- Plasma caliente: los átomos ionizados se calientan muchísimo, generando luz y calor, como en el caso del Sol.
Algunos ejemplos de plasmas: los rayos de una tormenta, la aurora boreal, las estrellas.
Los cambios de estado
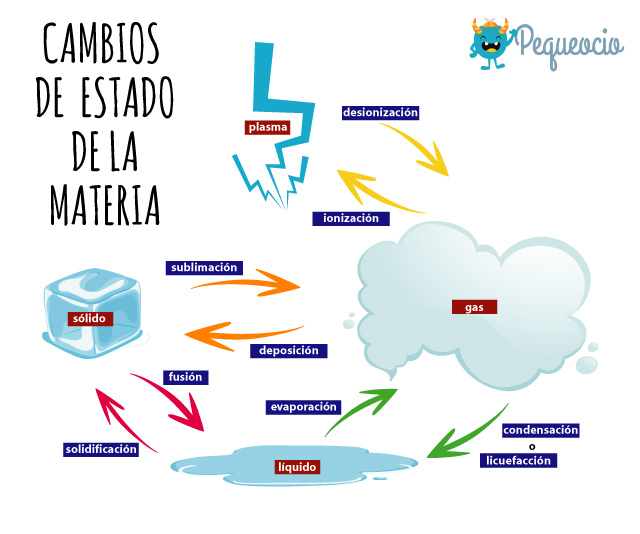
La materia puede pasar de un estado a otro si se alteran las condiciones de temperatura y presión en las que se encuentra. Aunque el estado cambie, las propiedades químicas de la sustancia no cambian; pongamos un ejemplo: si ponemos a hervir una olla con agua, cuando esta alcance los 100°C pasará del estado líquido al gaseoso (el vapor), pero el vapor seguirá estando compuesto por las mismas moléculas de hidrógeno y oxígeno.
Tipos de cambio de estado
Hay diferentes procesos de transformación de la materia:
- Vaporización o evaporación: se da cuando aplicando energía calórica (el calor) se transforma un líquido en un gas. Es el caso del agua que hierve que hemos explicado antes.
- Condensación: es el proceso inverso a la vaporización. Cuando un gas se enfría hasta un punto llamado “de rocío”, pasa del estado gaseoso al líquido. Es lo que sucede cuando nos damos una ducha caliente: el vapor del agua entra en contacto con la superficie fría de ventanas, espejos, etc. , y vuelve a transformarse en líquido, formando gotas.
- Licuefacción: cuando se somete a un gas a presiones altísimas y se baja su temperatura, se lo convierte en líquido. Es el método que se utiliza para almacenar gases como el GPL.
- Solidificación: es el paso de un líquido a un sólido por medio de enfriamiento. Un claro ejemplo es el hielo.
- Fusión: cuando se aplica energía calórica (calor) a un sólido para convertirlo en un líquido. El “punto de fusión” es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cada sustancia. Un ejemplo sencillo son los cubos de hielo que se derriten en un vaso con agua.
- Sublimación: algunos tipos de sólidos, al ser sometidos al calor, pasan al estado gaseoso sin pasar por el estado líquido. Un clásico ejemplo es el hielo seco.
- Deposición: algunos gases, cuando pierden energía calórica, se convierten en sólidos sin pasar por el estado gaseoso. También es llamado sublimación inversa.
- Desionización: es el cambio del estado plasmático al estado gaseoso.
- Ionización: pasaje de gas a plasma.
Otros tipos de estados de la materia
Existen otros estados de la materia que han sido descubiertos recientemente, pero que no se encuentran naturalmente en la Tierra, sino que han sido reproducidos en laboratorio, o teorizados. Vamos a verlos:
Condensado de Bose-Einstein
Lleva este nombre porque fue teorizado por Satyendra Nath Bose y Albert Einstein en 1927, pero recién en 1995 se logró obtenerla en un laboratorio. Los científicos lograron enfriar los átomos a temperaturas cercanas al cero absoluto (-273°C), obteniendo una sustancia en la que las partículas que la constituyen caen todas al mismo nivel de energía. Esa situación vulnera los principios de la física cuántica: las partículas se vuelven indistinguibles unas de otras y pasan a formar un “superátomo”.
Condensado de Fermi
El Condensado de Fermi o condensado fermiónico es similar al condensado de Bose-Einstein, pero se forma utilizando fermiones en lugar de bosones (son dos tipos de partículas). Fue creado por primera vez en 2003.
Otros posibles estados de la materia son:
- Supersólido: Este material es un sólido en el sentido de que la totalidad de los átomos del helio-(4) que lo componen están congelados en una película cristalina rígida, de forma similar a como lo están los átomos y las moléculas en un sólido normal como el hielo. Pero como la película es tan fría (apenas una décima de grado sobre el cero absoluto), los átomos de helio comienzan a comportarse como si fueran sólidos y fluidos a la vez.
- Superfluido: se caracteriza por la ausencia total de viscosidad, por lo que en un circuito cerrado fluiría interminablemente sin fricción.
- Materia degenerada: Bajo presiones extremas, como las que se dan en el núcleo de algunas estrellas, las partículas son comprimidas en un espacio mínimo. Dado que dos partículas no pueden ocupar el mismo espacio en el mismo momento, esto provoca que los átomos degeneren y pierdan su estructura.
No son los únicos, se han teorizado otros estados que no explicaremos aquí porque son realmente complejos, ¡todo lo que hemos aprendido hasta ahora es más que suficiente a nivel escolar! Si os interesa la ciencia no os perdáis estos artículos:
¿De cuánta utilidad te ha parecido este contenido?
¡Haz clic en las estrellas para puntuarlo!
Promedio de puntuación 4.8 / 5. Recuento de votos: 16
Hasta ahora, ¡no hay votos!. Sé el primero en puntuar este contenido.
¡Siento que este contenido no te haya sido útil!
¡Déjanose mejorar este contenido!
Dime, ¿cómo podemos mejorar este contenido?